"Mi fondo ma non mi scaldo"
Esperimento per capire la differenza tra calore latente e calore sensibile
Progettare una prova di laboratorio: obiettivi, conduzione, risultati, applicazioni
Proposta di una semplice attività di laboratorio rivolta agli insegnanti delle scuole medie inferiori e superiori.
Obiettivi
Comprendere la differenza esistente tra
calore sensibile e calore latente.
Comprendere che in tutti i cambiamenti di stato della materia la
temperatura non varia. (Questa affermazione ammette alcune eccezioni come, ad esempio
nel caso di certi tipi di
miscele).
Requisiti iniziali
Conoscenza del concetto di temperatura e di
calore;
Comprensione della differenza esistente tra calore e temperatura;
Conoscenza della scala termometrica dei
gradi Celsius;
Conoscenza degli stati della materia e dei relativi
cambiamenti di stato, con particolare riferimento all’acqua.
Strumenti occorrenti
Un bicchiere contenente ghiaccio a temperatura inferiore a 0 °C;
Un termometro con sonda e display digitale;
Opzionale: una fonte di calore concentrata (termosifone, fornelletto, ecc.) per accelerare i tempi d'esecuzione della prova.
Descrizione della prova
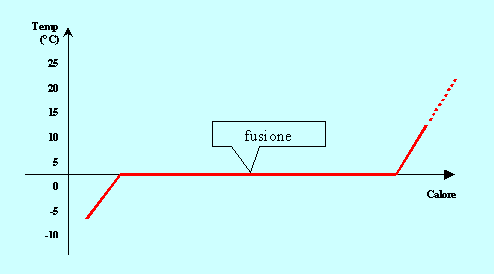
Inizialmente la temperatura del ghiaccio contenuto nel bicchiere aumenta.
Giunti a 0 °C la temperatura si stabilizza fino a quando tutto il ghiaccio non si è sciolto.
Avvenuto ciò, la temperatura ricomincia ad aumentare.

La situazione iniziale della prova. Si notano il termometro (-4,4 °C), la sonda ed il bicchiere contenente il ghiaccio
Conduzione dell'esperimento
Far notare che il bicchiere acquista calore dall’ambiente o dalla fonte di calore in quanto si trova ad una temperatura inferiore ad esso.
Far osservare l’andamento delle temperature del bicchiere nel tempo ed in particolare che, pur acquistando calore dall’esterno, esso mantiene la sua
temperatura costante a 0 °C dal momento in cui inizia la fusione del ghiaccio fino a quando essa non ha termine
Invitare a confrontare il tempo necessario per la fusione completa del ghiaccio e il tempo necessario all'innalzamento della temperatura (anche di molti
gradi) dell'acqua.
Diagrammare le temperature misurate in un grafico
Risultati attesi
Ecco la rappresentazione grafica qualitativa attesa dall’esperimento:
Conclusioni
Calore e temperatura sono due grandezze fisiche in relazione tra loro, ma non sempre una somministrazione o una sottrazione di calore ad un corpo
comporta una variazione della sua temperatura. Infatti durante un cambiamento di stato il calore che viene fornito o sottratto al corpo viene “consumato”
dalla sostanza stessa per modificare i legami interatomici che portano alla modifica dello stato della materia. La quantità di calore (latente, cioè
“nascosto”, poiché non implica una variazione di temperatura) necessaria per far avvenire il cambiamento di stato risulta di entità molto superiore rispetto
alla quantità di calore (sensibile, cioè che porta ad un aumento della temperatura della sostanza) che è necessario fornire/sottrarre alla sostanza anche
per produrre una notevole variazione della sua temperatura.
Quanto osservato per l’acqua è estendibile a tutti i tipi di sostanze, ivi compresi i normali
refrigeranti utilizzati nell’industria del
freddo, purché essi siano monocomponenti.
Applicazioni
In un
circuito frigorifero il calore latente utilizzato per
sbrinare l’evaporatore, quando è ricoperto di ghiaccio, non porta ad un aumento della temperatura
al di sopra di 0 °C all’interno del vano refrigerato. Di conseguenza i cibi conservati non subiscono un aumento eccessivo di temperatura, che potrebbe essere
dannoso per la loro corretta
conservazione nel tempo.
In un circuito frigorifero l’evaporatore viene attraversato da un liquido refrigerante che, acquistando calore da un fluido (aria o acqua) posto al
di fuori dell’evaporatore stesso, ne produce il raffreddamento mediante la sottrazione di una certa quantità di calore. Tale calore, producendo
il cambiamento di stato del refrigerante, è di tipo latente.
Un corpo che sta subendo un repentino riscaldamento può essere raffreddato o comunque mantenuto a temperatura costante semplicemente avvolgendolo con
uno straccio bagnato (il calore, infatti, viene “consumato” dal processo di evaporazione dell’acqua contenuta nello straccio).
La cottura della pastasciutta avviene a temperatura costante in quanto durante tale fase l’acqua è in ebollizione
 Nell'igloo di Fred trovi anche
Nell'igloo di Fred trovi anche
Il circuito frigorifero
Cambiamenti di stato
Temperatura
Unità di misura della temperatura
Energia
Calore ed energia termica
Differenza tra calore latente e calore sensibile
Calore specifico
"Acqua e sale". Esperimento di laboratorio
Sbrinamento elettrico dell'evaporatore
Quanto calore per congelare?
Quanto calore per raffreddare?
Conservare gli alimenti in frigorifero
Refrigeranti
Miscele di refrigeranti
Cambiamenti di stato
Temperatura
Unità di misura della temperatura
Energia
Calore ed energia termica
Differenza tra calore latente e calore sensibile
Calore specifico
"Acqua e sale". Esperimento di laboratorio
Sbrinamento elettrico dell'evaporatore
Quanto calore per congelare?
Quanto calore per raffreddare?
Conservare gli alimenti in frigorifero
Refrigeranti
Miscele di refrigeranti



