Evaporazione ed ebollizione
Differenza tra i due fenomeni
Vaporizzazione - Fase liquida - Fase vapore - Vapore saturo - Pressione - Temperatura di saturazione
I fenomeni dell'evaporazione e dell'ebollizione talvolta vengono confusi tra loro.
Ma, in realtà, essi sono diversi uno dall'altro.
Entrambi portano al passaggio di stato da liquido a
vapore, cioè alla vaporizzazionee. Le modalità con cui tutto ciò avviene sono diverse.
 Nell'igloo di Fred trovi anche
Nell'igloo di Fred trovi anche
Evaporazione
Nell'evaporazione le molecole più prossime alla superficie libera del liquido abbandonano il liquido stesso e passano nell'aria. Questo avviene grazie anche a minime quantità di energia termica acquistate da tali molecole.
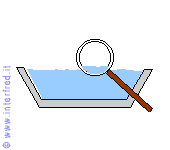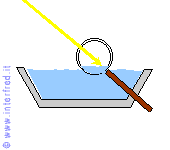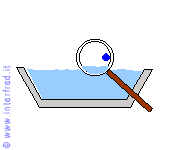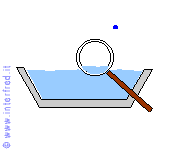
L'aumento del loro grado di agitazione termica permette alle particelle di avere una maggiore velocità media e quindi di vincere le forze (tra cui anche la forza di gravità) che le mantengono nella fase liquida.
Ovviamente il numero delle particelle in grado di abbandonare il liquido dipende dall'estensione della sua superficie: più essa è grande maggiore è
il numero di molecole che possono lasciare il liquido.
Infine, l'evaporazione risulta più veloce quanto minore è la pressione agente
sul liquido: infatti, in questo caso, le particelle riescono ad abbandonare più agevolmente il liquido, in quanto risulta minore la forza che
contrasta tale passaggio.
L'evaporazione può avvenire a qualsiasi temperatura.
 Nell'igloo di Fred trovi anche
Nell'igloo di Fred trovi anche
Ebollizione
L'ebollizione è un fenomeno che interessa tutto il volume del liquido.
Fornendo ad esso energia termica, si formano al suo interno delle piccole bollicine di vapore saturo, la cui pressione interna aumenta all'aumentare
del riscaldamento. Così le bollicine aumentano progressivamente le loro dimensioni.

Quando la loro pressione interna supera la pressione esterna al liquido (che può essere, per esempio, la
pressione atmosferica) le bolle esplodono dando
luogo al ben noto tumultuoso fenomeno dell'ebollizione.
L'ebollizione si svolge a temperatura costante. Il valore di tale temperatura (temperatura di saturazione) dipende dalla pressione esterna al liquido.
 Nell'igloo di Fred trovi anche
Nell'igloo di Fred trovi anche







